

Электрохимическая коррозия – это разрушение металла в растворах электролитов.
В нашем случае объектом изучения является металлический трубопровод, проложенный в грунте (или другое металлическое сооружение). Разрушению подвергается металл трубопровода. В качестве электролита выступают почвенно-грунтовые воды, являющиеся водными растворами солей, содержащихся в грунте.
Чтобы понять принцип катодной защиты необходимо выяснить, что происходит с металлом в среде электролита.
Металлы – это твердые вещества, имеющие кристаллическое строение. Единица кристаллической решетки – элементарная кристаллическая ячейка, в узлах и на гранях которой находятся положительно заряженные ионы, между которыми свободно перемещаются электроны.
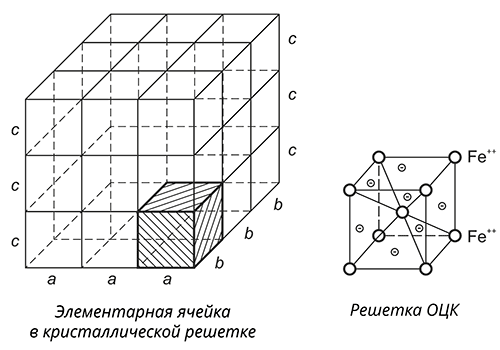
Кристаллическое строение металла
Элементарной кристаллической решеткой железа является объёмоцентрированный куб (ОЦК), в котором в узлах кристаллической решетки и в центре расположены малоподвижные ионы железа, между которыми движутся свободные электроны.
В ячейке заряд ионов уравновешен зарядом электронов. Но такое «равновесное» состояние может наблюдаться только в вакууме. Как только металл погружается в какую-либо среду, в нашем случае, в электролит, к его поверхности начинают притягиваться ионы электролита соответствующего заряда.
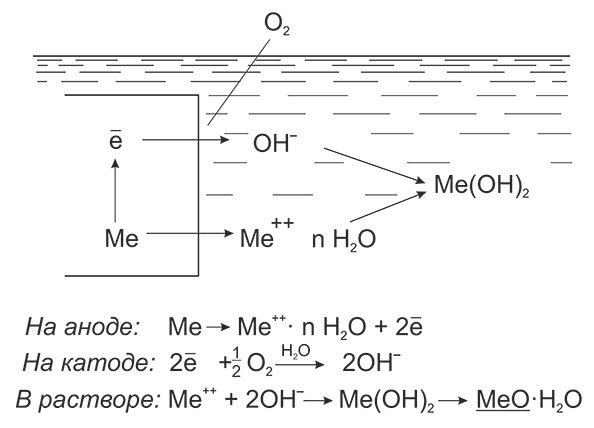
Схема электрохимического окисления металлов
Чтобы оторвать друг от друга ионы, находящиеся в кристаллической решетке, и перевести их в раствор, необходимо преодолеть силу притяжения этой решетки, т.н. «энергию кристаллической решетки».
При растворении в воде такой силой является притяжение ионов решетки металла молекулами воды, характеризуемой т.н. энергией гидратации.
Если энергия гидратации по сравнению с энергией кристаллической решетки будет достаточно велика, то ионы металла (Fe) будут отрываться от решетки и перейдут в раствор.
В этом и заключается анодный процесс электрохимической коррозии, а именно: переход ионов металла в раствор и их гидратация.
Если бы никаких других электродных процессов в системе не происходило, то анодный процесс скоро должен был бы прекратиться. Накопление электронов в металле и катионов в растворе будет создавать сильное смещение электродного потенциала металла в отрицательную сторону, создавая тем самым барьер для дальнейшего протекания анодного процесса.
Однако в системе протекает катодный процесс ассимиляции электронов содержащимся в растворе деполяризатором, способным восстанавливаться (поглощать электроны) на катоде.
В рассматриваемом случае деполяризатором является кислород, и на катоде протекает реакция восстановления кислорода с превращением его в ион гидроксила – кислородная деполяризация.
Материальный эффект коррозионного разрушения металла при таком механизме будет проявляться преимущественно на анодах, на катодных участках, где происходит процесс деполяризации, ощутимых потерь металла не будет.
В случае если в результате взаимодействия ионов металла с ионами раствора новые соединения не образуются, процесс растворения будет протекать беспрепятственно вплоть до полного разрушения металла.